2023-10-26
来源:上海百沐生物科技有限公司
所属分类:单细胞测序

胰岛细胞对葡萄糖代谢起着重要的调节作用,它们在衰老过程中的功能减退会导致葡萄糖耐量下降甚至糖尿病[1]。随着年龄的增长,胰岛以及2型糖尿病(T2D)中会堆积衰老细胞[2];相反,清除衰老的胰岛细胞可改善胰腺内分泌功能并恢复葡萄糖稳态[3]。这有力地支持了衰老、胰岛细胞功能衰竭和糖尿病之间的联系。因此,对衰老的胰岛细胞分子变化的更好理解可能有助于保持或再生内分泌功能,从而为抑制衰老过程中糖尿病的发展开辟了新的治疗机会。
胰岛由四种主要的内分泌细胞类型组成:产生胰高血糖素的a细胞,产生胰岛素的b细胞,产生生长抑素的d细胞和产生胰多肽的PP细胞[4]。这些细胞彼此相互作用,并以多激素协同的方式调节葡萄糖稳态[5]。胰岛的细胞组成和拓扑结构在不同的哺乳动物物种之间有所不同[4]。由于样品可用性和伦理问题的局限性,人们对胰岛生物学的了解仍然很少。食蟹猴等非人类灵长类动物(NHP)在胰腺结构和糖尿病易感性方面与人类相似,为研究灵长类动物胰岛衰老提供了比较好的模型。因此,获得和分析从食蟹猴分离的胰岛将使人们能够更好地理解与衰老相关的糖尿病的病因基础。
2020年6月10日,中国科学院动物研究所曲静课题组、刘光慧课题组、北京大学汤富酬课题组与中国科学院北京基因组研究所张维绮课题组合作在National Science Review发表题为A single-cell transcriptomic atlas of primate pancreatic islet aging的研究论文,该研究系统绘制了非人灵长类胰岛衰老的单细胞转录图谱,揭示了蛋白稳态失衡是胰岛β细胞衰老的关键特征。
单细胞RNA测序(scRNA-seq)的最新进展已允许从单个内分泌细胞收集转录组数据,并在代谢性疾病出现期间分析特定细胞类型的变化。首先,研究人员以单细胞分辨率组装了非糖尿病食蟹猴的胰岛衰老图谱,鉴定了内分泌的a、b、d和PP细胞(图1)并且分析了衰老对细胞类型特异性表达基因的影响。尽管存在性别二态性和转录噪声,但未折叠的蛋白应答(UPR)仍是受衰老影响的主要途径,在β细胞中这种现象尤为明显。
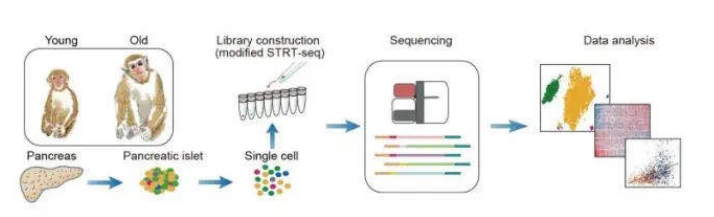
图1 食蟹猴胰岛衰老的单细胞转录组图谱建立
之后,研究人员对于β细胞进行了单独的分析。通过衰老的β细胞与衰老相关基因的差异表达分析,研究人员确定了一些调控这一过程潜在的转录因子(图2)。分析显示,UPR基因在ATF6和IRE1信号通路中的表达逐渐升高。HSP90B1是上调程度最高的基因之一,在衰老的β细胞中特异性增加。葡萄糖暴露后,胰岛细胞中HSP90B1的外源表达导致胰岛素分泌受损,这表明UPR蛋白在调节胰岛素分泌和葡萄糖感测中起关键作用。
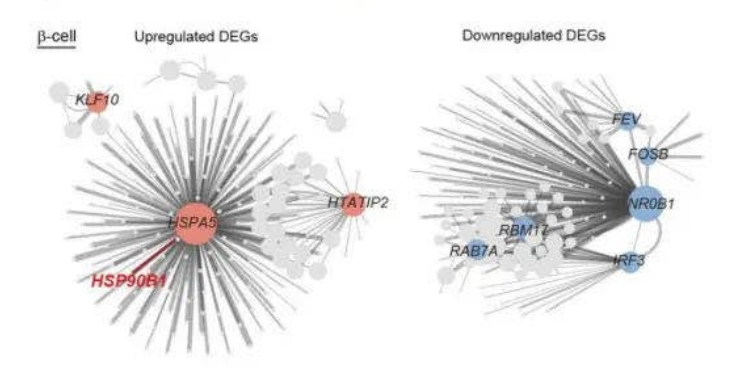
图2 衰老过程中β细胞转录组变化
在这项研究中,研究人员为非人类灵长类动物的胰岛细胞提供了完整的单细胞转录组图。其次,UPR途径的ATF6和IRE1分支在衰老的b细胞中上调。最后,他们的数据记录了一种分子状态,即在衰老的b细胞中,自适应性UPR被激活而不是促凋亡性UPR信号传导。并且揭示了HSP90B1是男女胰岛b细胞潜在的衰老效应子,并且细胞中的上调会损害葡萄糖诱导的胰岛素分泌(图3)。总的来说,这项研究为衰老相关的葡萄糖不耐症提供诊断的生物标志物和治疗靶标。
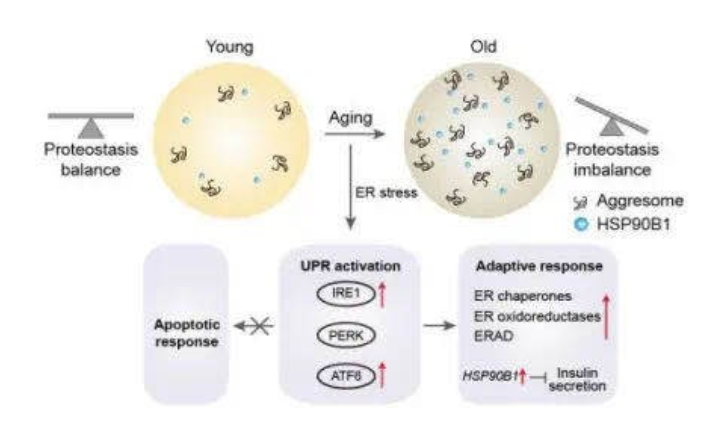
图3 β细胞衰老的分子机制
原文链接:
https://academic.oup.com/nsr/advance-article/doi/10.1093/nsr/nwaa127/5855510
参考文献:
[1] Kushner, JA. The role of aging upon β cell turnover. The Journal of Clinical Investigation. 2013; 123(3): 990-5.
[2] Helman, A, Klochendler, A, Azazmeh, N, et al. p16Ink4a-induced senescence of pancreatic beta cells enhances insulin secretion. Nature Medicine. 2016; 22(4): 412-20.
[3] Aguayo-Mazzucato, C, Andle, J, Lee, TB, et al. Acceleration of β Cell Aging Determines Diabetes and Senolysis Improves Disease Outcomes. Cell Metabolism. 2019; 30(1): 129-42.e4.
[4] Dolenšek, J, Rupnik, MS, Stožer, A. Structural similarities and differences between the human and the mouse pancreas. Islets. 2015; 7(1): e1024405.
[5] Aronoff, SL, Berkowitz, K, Shreiner, B, et al. Glucose Metabolism and Regulation: Beyond Insulin and Glucagon. Diabetes Spectrum. 2004; 17(3): 183-90.
 在线咨询
在线咨询 微信咨询
微信咨询

 电话咨询
电话咨询
联系电话:191 2100 2160
 顶部
顶部
百沐生物孵化于复旦大学,核心团队由复旦大学、中科院、协和医院等知名科研院所的卓越科学家以及来自阿里、美团、小米、生物医药集团等头部互联网科技公司和大型药企集团的综合背景精英组成,专注于将人工智能(AI)技术与生物技术(BT)深度融合,为生命科学研究和精准医疗领域带来创新解决方案。 公司核心平台为自研单细胞平台(BMBIOS)和小沐AI平台(AIGOBIO)。

微信联系我们