2023-10-26
来源:上海百沐生物科技有限公司
所属分类:单细胞测序
目前,糖尿病已经成为一个严重的全球性公共卫生问题,它是一种以慢性血糖水平增高为特征的代谢性疾病,是由于胰岛素分泌和(或)作用缺陷所引起。胰岛素分泌不足是一型糖尿病和二型糖尿病的共同特点,这些病人往往需要外源补充胰岛素才能正常生活。
胰岛β细胞是人类以及几乎所有其他脊椎动物中唯一产生胰岛素的细胞,β细胞的再生能力有限是糖尿病发展的重要原因[1]。近年来兴起了不同于传统注射胰岛素的方法来治疗糖尿病,细胞治疗就是一种潜在疗法。通过胰岛移植,β细胞可以得到补充从而维持体内血糖稳态[2]。由于胰岛供体的局限性,寻找体外培养产生β细胞的方法就成了当务之急。基于胚胎干细胞(ESC)/诱导性多能干细胞(iPSC)的技术已经得到了长足的发展[3,4],能否直接由成体干细胞衍生出目标组织的类器官成为了当下的研究热点。成年胰岛当中是否存在干细胞一直是领域里值得讨论的问题,因此胰岛干细胞的发现就成为得到胰岛类器官最大的难点。
中国科学院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)曾艺课题组长期致力于成体干细胞的研究,已经在多个组织中发现了具有干细胞特性的细胞群体并揭示了这些干细胞在发育以及疾病发生发展当中的重要作用[5,6]。2020年3月19日,曾艺课题组在Cell发文Long-Term Expansion of Pancreatic Islet Organoids from Resident Procr+ Progenitors。这项工作鉴定了小鼠的成体干细胞,并在体外培养获得了具有功能的胰岛类器官,这为糖尿病的治疗提供了新的思路与方法。
Procr(蛋白C受体)是一种表面蛋白,据报道Procr可以标记包括乳腺[5],内皮[6]和造血系统[7]几种成年组织中的干细胞。研究人员首先通过单细胞测序的方法在成年胰岛中搜索Procr+细胞(图1/图2),他们发现了一种带有Procr标签且具有上皮间质转化特性的细胞类群。接下来,研究人员通过转基因老鼠(Procr-mGFP-2A-LacZ)和谱系示踪确定了Procr+胰岛细胞是成人多能内分泌祖细胞。

图1 单细胞测序鉴定新的细胞类群
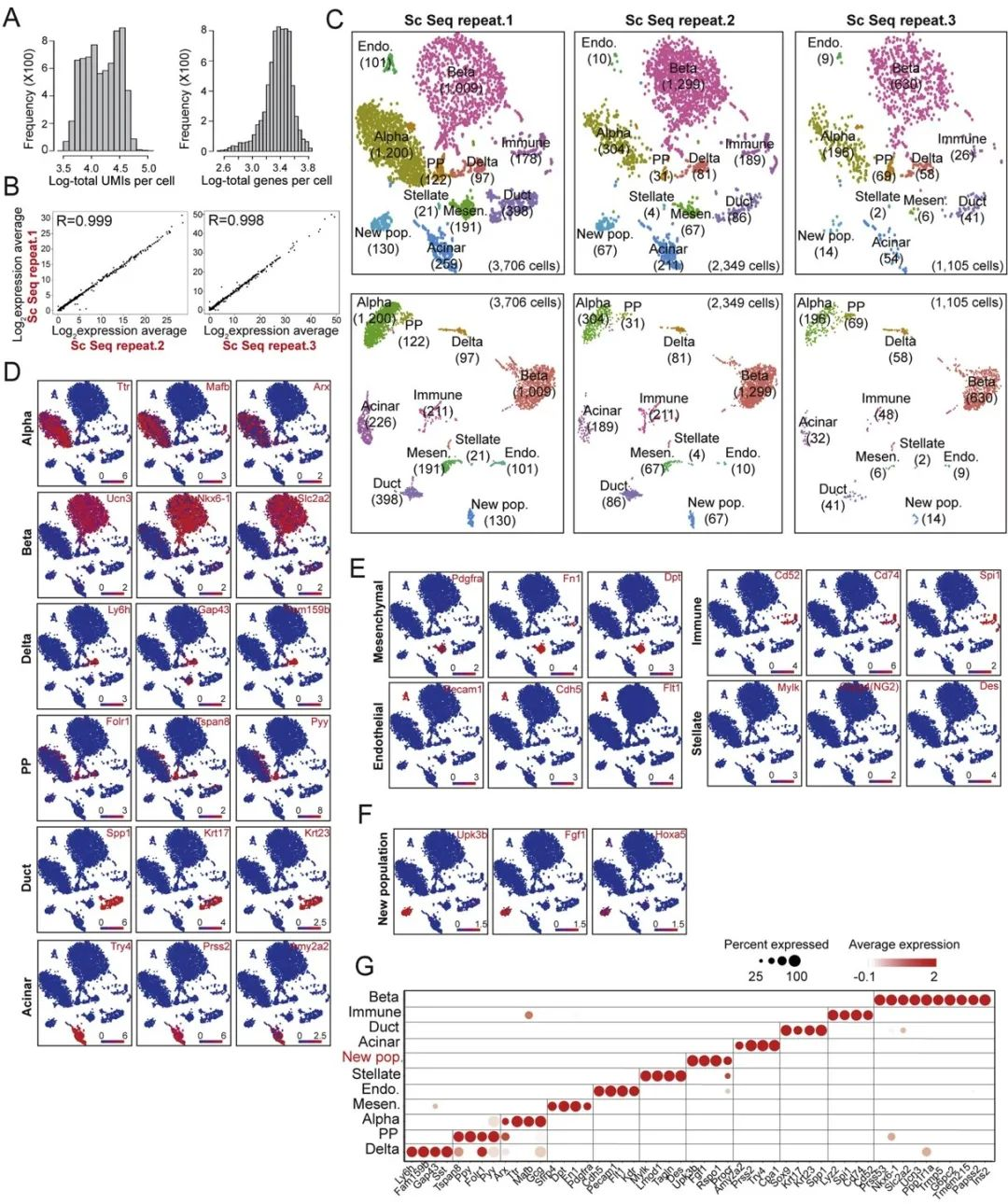
图2 小鼠胰腺细胞的单细胞RNAseq
进一步地,研究人员想探究Procr+胰岛细胞是否可以作为体外新β细胞的细胞来源,即能否在体外形成胰岛类器官并具有正常胰岛的功能。他们建立了一种3D培养体系并且在体外成功获得了具有正常功能的胰岛类器官(图3)。为了深入了解类器官培养过程中的β样细胞分化过程,研究人员通过scRNA-seq对体外培养不同时期的类器官进行了分析。他们将数据与原代胰岛细胞数据整合在一起,并分析了培养过程中产生的转录状态(图4)。令人惊喜的是,研究人员发现这种类器官在体外可以进行多次传代,并且细胞的增殖和分化能力可以长期维持。在糖尿病小鼠模型当中,移植的类器官能够分泌胰岛素并改善进行性高血糖症,具有治疗糖尿病的作用。
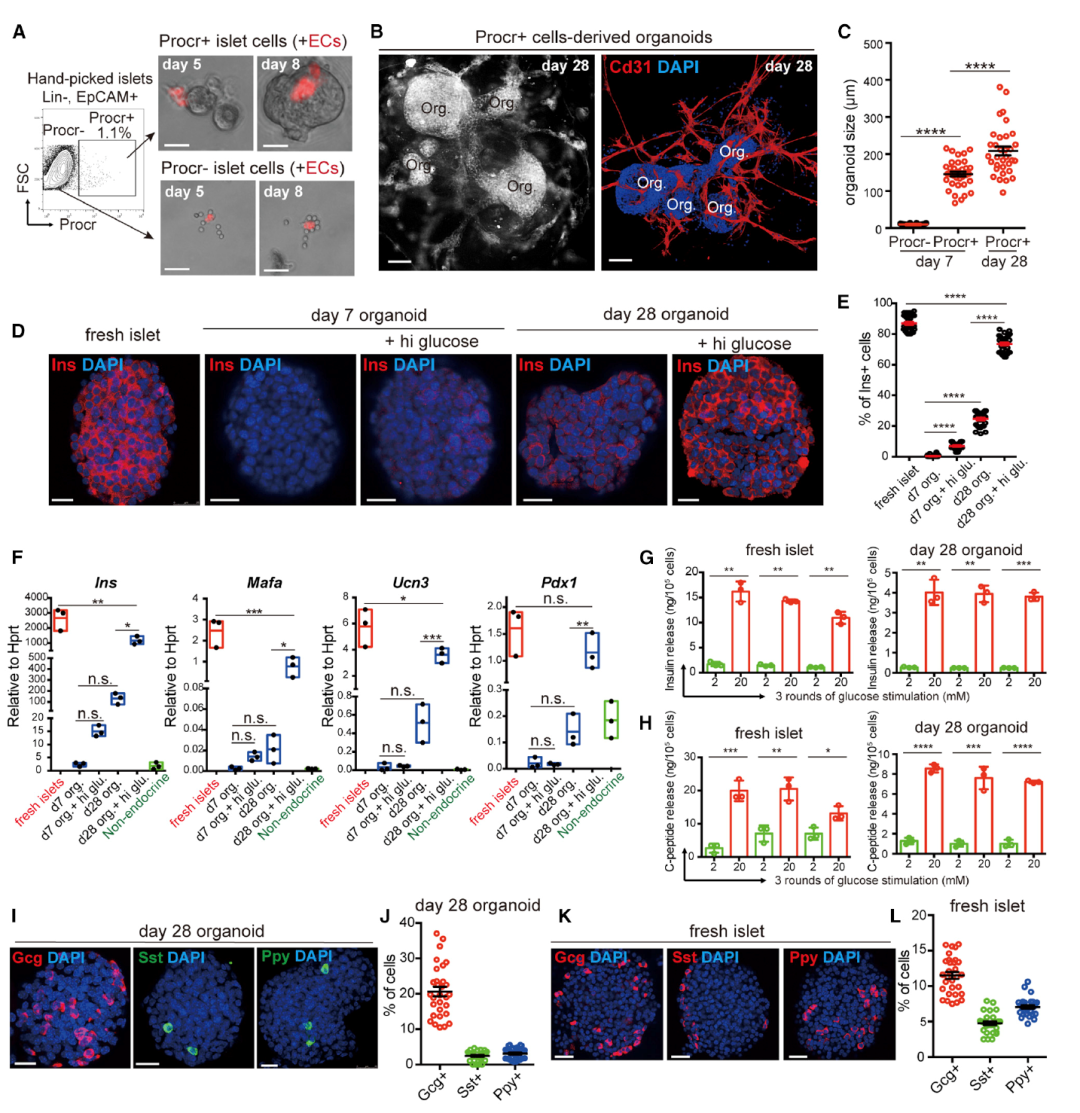
图3 由Procr+胰岛细胞产生的功能性胰岛类器官
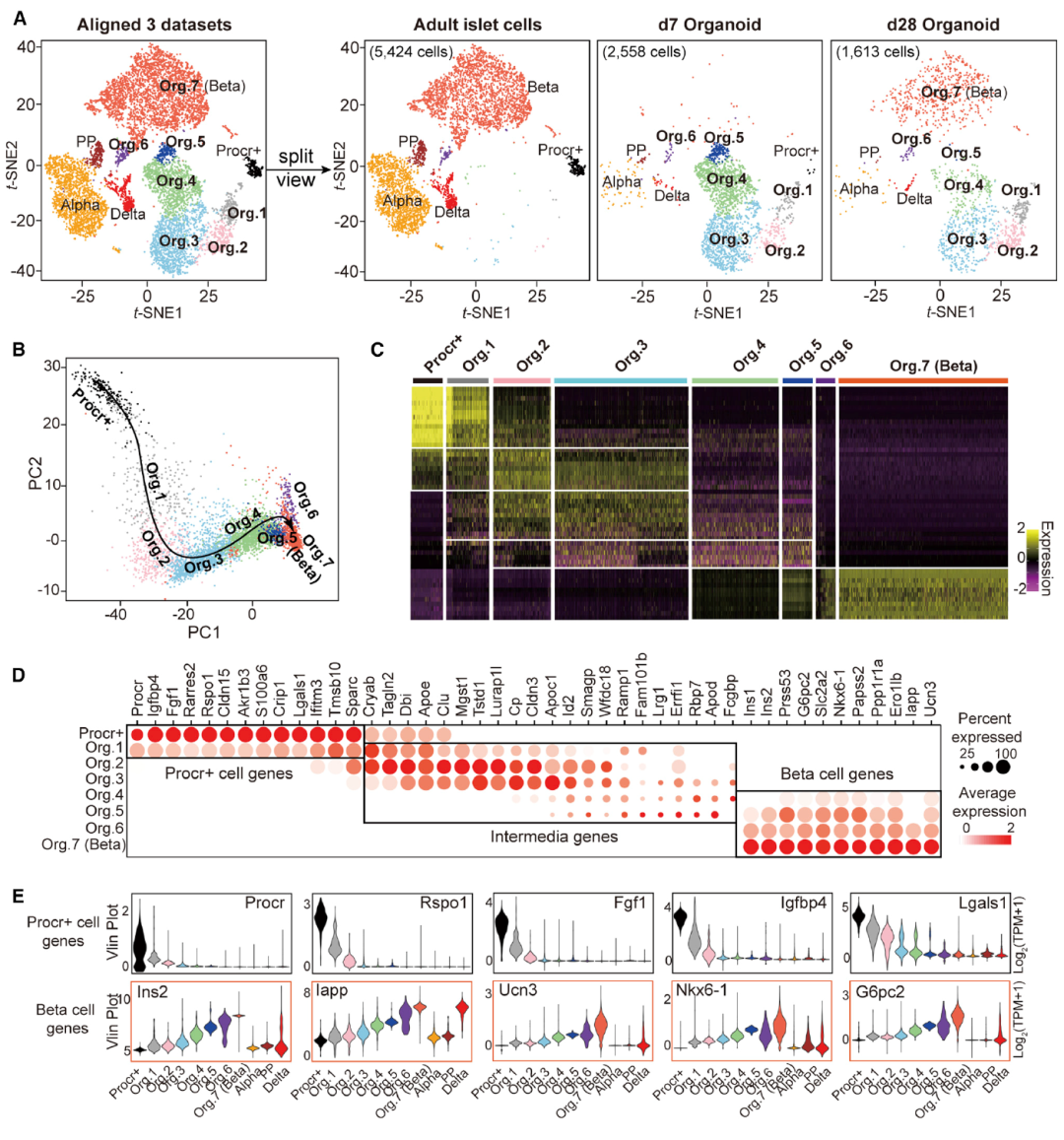
图4 scRNA-seq分析揭示了β细胞的体外成熟途径
这项工作充分地利用了单细胞测序技术鉴定了成年小鼠胰岛中的新型内分泌祖细胞,并建立了诱导和长期扩增胰岛类器官的体外方法,为未来糖尿病的治疗提拱了理论和技术的支持。可见单细胞测序技术在今后的科研领域当中发挥着不可或缺的作用,能帮助我们解开更多未知的谜团。
原文链接:
https://www.sciencedirect.com/science/article/pii/S0092867420302257?via%3Dihub
参考文献:
[1] Hardikar, A.A. (2016). Pancreatic Islet Biology, First Edition (Springer International Publishing).
[2] Lysy, P.A., Weir, G.C., and Bonner-Weir, S. (2013). Making b cells from adult cells within the pancreas. Curr. Diab. Rep. 13, 695–703.
[3] Cheng, X., Ying, L., Lu, L., Galva˜ o, A.M., Mills, J.A., Lin, H.C., Kotton, D.N., Shen, S.S., Nostro, M.C., Choi, J.K., et al. (2012). Self-renewing endodermal progenitor lines generated from human pluripotent stem cells. Cell Stem Cell 10, 371–384.
[4] Pagliuca, F.W., Millman, J.R., Gu¨ rtler, M., Segel, M., Van Dervort, A., Ryu, J.H., Peterson, Q.P., Greiner, D., and Melton, D.A. (2014). Generation of functional human pancreatic b cells in vitro. Cell 159, 428–439.
[5] Wang, D., Cai, C., Dong, X., Yu, Q.C., Zhang, X.O., Yang, L., and Zeng, Y.A. (2015). Identification of multipotent mammary stem cells by protein C receptor expression. Nature 517, 81–84.
[6] Yu, Q.C., Song, W., Wang, D., and Zeng, Y.A. (2016). Identification of blood vascular endothelial stem cells by the expression of protein C receptor. Cell Res. 26, 1079–1098.
[7] Fares, I., Chagraoui, J., Lehnertz, B., MacRae, T., Mayotte, N., Tomellini, E., Aubert, L., Roux, P.P., and Sauvageau, G. (2017). EPCR expression marks UM171-expanded CD34+ cord blood stem cells. Blood 129, 3344–3351.
 在线咨询
在线咨询 微信咨询
微信咨询

 电话咨询
电话咨询
联系电话:191 2100 2160
 顶部
顶部
百沐生物孵化于复旦大学,核心团队由复旦大学、中科院、协和医院等知名科研院所的卓越科学家以及来自阿里、美团、小米、生物医药集团等头部互联网科技公司和大型药企集团的综合背景精英组成,专注于将人工智能(AI)技术与生物技术(BT)深度融合,为生命科学研究和精准医疗领域带来创新解决方案。 公司核心平台为自研单细胞平台(BMBIOS)和小沐AI平台(AIGOBIO)。

微信联系我们