
靶向代谢组学则是对一组特定的化合物进行检测,通过使用内标,可以对化合物进行定量或者半定量分析。
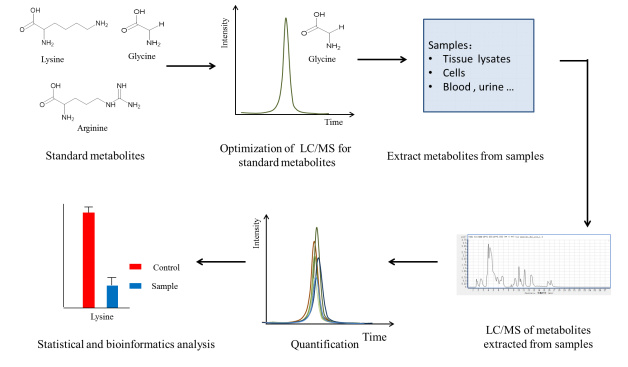
在食品鉴定、疾病研究、动物模型验证、生物标志物发现、疾病诊断、药物研发、药物筛选、药物评估、临床研究、植物代谢研究、微生物代谢研究中发挥重要作用。
• 验证非靶向代谢组学的实验结论
• 分子机制研究
• 疾病标志物的筛选
1.实时追踪项目进展,一切动向尽在掌握。
2.丰富的技术实力和经验,意见直接反馈项目负责人,高效解决。
3.可对在线项目各维度的服务进行评价。
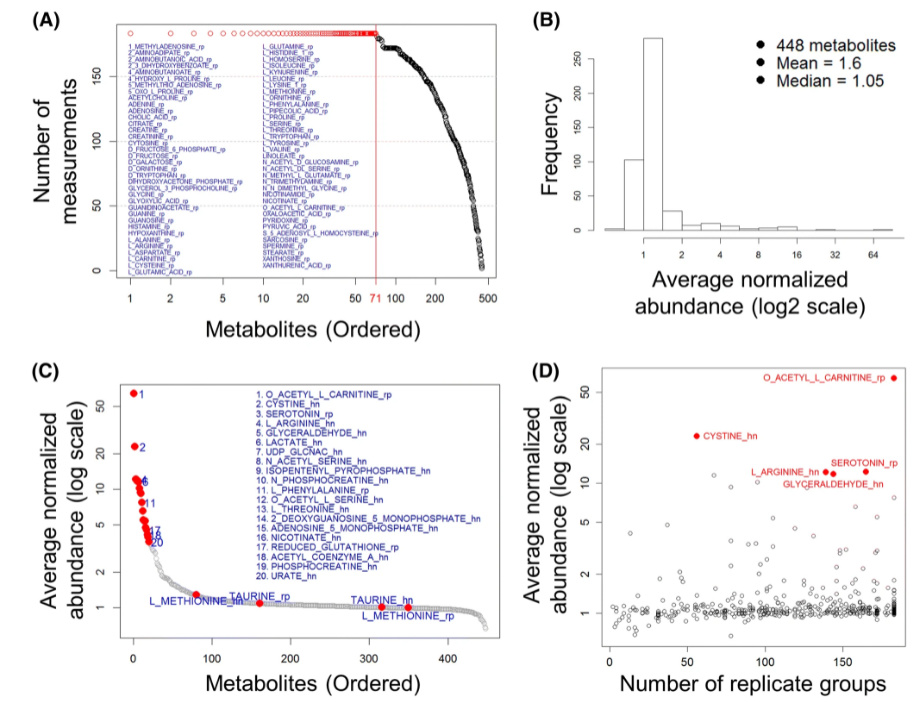
相对丰度分析
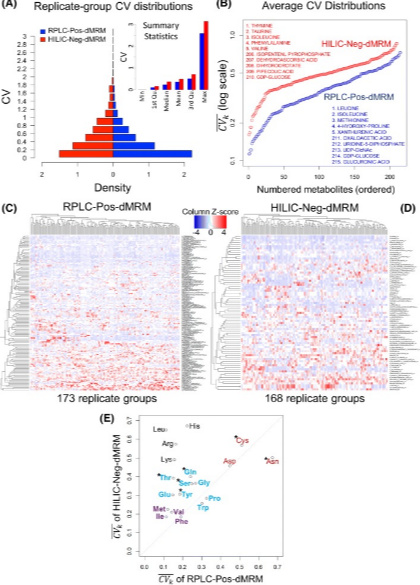
重复组CV分析
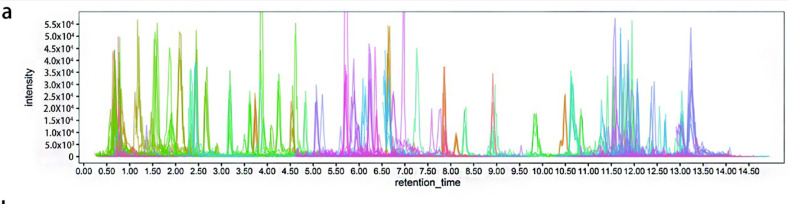
通过广泛靶向代谢组学方法获得的代表性总离子色谱图
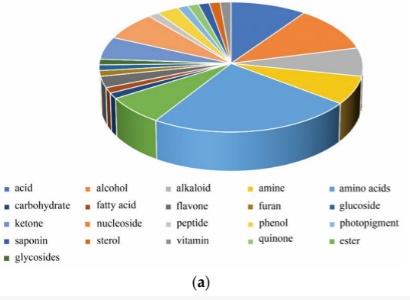
差异表达代谢物分类饼图
Cao G, Song Z, Hong Y, et al. Large-scale targeted metabolomics method for metabolite profiling of human samples. Analytica Chimica Acta, 2020, 1125: 144-151.
靶向代谢组学在定量方面具有显著的优势,但代谢物覆盖率较低。在这项研究中,我们开发了一种大规模的靶向代谢组学方法,并将其应用于各种人类样本。这种方法最初涉及使用超高效液相色谱(UHPLC)结合高分辨率轨道阱质谱(MS)对人体细胞、组织和体液中的代谢物进行无偏鉴定。利用which三重四极杆质谱建立了靶向代谢组学方法,该方法能够对超过400种生物学上重要的代谢物(例如,氨基酸、糖、核苷酸、二肽、辅酶和脂肪酸)进行靶向分析,涵盖92种代谢途径(例如,克雷布斯循环、糖酵解、氨基酸代谢、氨再循环和一碳代谢)。本方法显示出比基于Orbitrap MS的非靶向代谢组学方法更好的灵敏度、可重复性和线性,并在肺癌生物标志物发现中表现出优异的性能,其中107种差异代谢物能够区分癌和邻近正常组织,暗示了Warburg效应、氧化还原状态的改变和肺癌的核苷酸代谢。
Jia H, Liu C, Li D, Huang Q, Liu D, Zhang Y, Ye C, Zhou D, Wang Y, Tan Y, Li K, Lin F, Zhang H, Lin J, Xu Y, Liu J, Zeng Q, Hong J, Chen G, Zhang H, Zheng L, Deng X, Ke C, Gao Y, Fan J, Di B, Liang H. Metabolomic analyses reveal new stage-specific features of COVID-19. Eur Respir J. 2022 Feb 24;59(2):2100284. doi: 10.1183/13993003.00284-2021. PMID: 34289974; PMCID: PMC8311281.
识别新冠肺炎的潜在分子机制对于战胜疫情是至关重要的,该研究分别设置两个队列,发现队列为:轻症(18例)、重症(12例)、恢复组(20例)、健康组(13例),验证队列为:轻症(46例)、重症(22例)、恢复组(22例)、健康组(28例),使用非靶向和靶向代谢组学分析对新冠肺炎患者所有阶段血清的代谢特征进行了全面的检测。研究发现,与健康对照组相比,在发现队列和验证队列中观察到轻度、重度和恢复阶段循环代谢物的不同改变模式,表明葡萄糖代谢和尿素循环的代谢重编程是COVID-19进展的潜在病理机制。

为避免PEG等污染,推荐使用优质厚壁离心管或冻存管,特殊样品可采用干净的锡箔纸包裹样品后装在自封袋中(标记贴在自封袋上),每个锡箔纸均独立包装,离心管切记不要高温高压灭菌;建议用封口膜密封离心管;避免使用易碎的容器装载样品。 | |
代谢组学要求每组至少6-10个样品重复,整个项目样品数量较大,因此标识要清晰,防止样品错乱; 样品名称使用字母、数字和下划线,不超过8个字符,不要使用特殊符号,建议双重标记: 标记1:使用优质油性笔在每个样品管顶部和侧壁上清晰、简明地标记样品名称,并用封口膜包裹一圈; 标记2:将样品名称等信息写在标签纸上,贴在管壁,再用透明胶带缠绕一圈,防止浸湿脱落。 需要特别指出的是,代谢组学要求原始样品尽可能精确称量,液体根据体积,固体根据重量,细胞根据数量,尽量按照相同的量进行分装,或根据每管实际情况精确标注。 | |
邮寄样品时请详细填写样品信息单,所列名称与样品管标识完全一致。建议采用顺丰快递,样品置于泡沫盒,并用干冰覆盖,通常15kg干冰可满足要求,一般情况,干冰数量=(快递天数+1)×5kg,所有样品请做好备份,防止寄送过程出现异常导致样品损坏。 | |
若样品有潜在危险,如有毒、易感染、易腐蚀等,请提前联系技术人员,根据具体情况,制定相应方案;如擅自寄送有危险性样品且未告知,需承担相应法律责任。 如果样品为病原性微生物或者具有侵染性的病变组织务必灭活后再送样并在样品登记表上注明。 | |
样本质量是影响实验结果的关键因素,建议遵循以下原则: 代表性和一致性原则:各组样本在取材部位、时间、处理过程等方面尽可能保持一致;取样部位要具有代表性,准确的分离病变组织和对照组织;针对高异质性组织,更需要做到精确取材; 迅速性原则:样本在采集、制备、分离、冻存等过程中应尽可能做到迅速,尽量减少操作时间过长对样品产生的影响。 全程低温原则:所取样本离体后,如有分离步骤应在低温下进行,分离好的样品立即置于液氮、干冰或-80℃冰箱中,并在实验前始终处于-70℃以下,切忌反复冻融。 注:1、液体样本在冷冻之前保持管口朝上直立,确保全部样本留存在管底再冻存。 2、样品不得出现固液混合状态,例如液体浸泡的组织,含培养基的细胞或微生物,含水量过大的污泥。液体样品需离心取上清,固体样品需完全去除液体。 | |
客户对原始样品进行过预处理,应将处理方法及试剂提前告知,否则公司可视情况终止实验,且实验结果不理想由客户自己承担。 以下建议送样量仅为参考数值,样本是否满足后续实验要求,以实际样品制备的最终情况为准;在条件允许的情况下,实际样品准备量应尽量大于该参考标准;液体样本量较大的时候建议分装。 样本提取时,一般只取用实验所需的样本量,但不排除样本全部取用的可能性,若样本不可用完,请在送样单中进行备注,否则默认样品可以全部取用。 实验过程中会存在低概率不可控风险,建议客户采集备份样本。“×2”意为额外准备一份备份样本,客户可以选择自己将备份保存在低温冰箱或者与实验样本一起寄送(不包括生物学重复)。除以下所列样品之外的其它样品,其样本送样量可视具体情况进行沟通后确认。 关于靶向实验的收集样品方法和样品量,建议与实验技术人员沟通之后再反馈给客户。 |
样品类型 | 样品要求 |
细胞 | ≥107 ×2份 |
细胞上清 | ≥500 μL ×2份 |
动物组织 | ≥50 mg ×2份 |
植物组织 | ≥50 mg ×2份 |
体液(血液、尿液、组织液等) | ≥100 μL ×2份 |
发酵液 | ≥500 μL ×2份 |
微生物 | ≥50 mg ×2份 |
微生物上清 | ≥500 μL ×2份 |
粪便/肠道内容物 | ≥50 mg ×2份 |
土壤/污泥 | ≥1 g ×2份 |
细胞样品 | 样品准备步骤 |
贴壁细胞
| 采用胰酶消化或刮刀刮取后,PBS重悬并精确计数,按照相同的细胞量分装至新的1.5mL离心管中,1000×g离心5min,弃上清后完全吸弃液体,液氮速冻后,-80℃冰箱保存。若已知培养皿中细胞的精确数量,可直接倒掉培养基,用PBS快速清洗三遍,用移液枪彻底吸尽清洗液后,将培养皿放在-20℃金属块上。每皿加入1.2 mL于-20℃预冷的甲醇,用细胞刮刀刮下细胞,并完全转移至1.5 mL离心管中,1000×g离心5min,弃上清后完全吸弃液体,液氮速冻后,-80℃冰箱保存。 |
悬浮细胞
| 1000×g离心5min收集细胞至15mL离心管中,弃上清后,用预冷的10mL PBS溶液重悬并离心清洗细胞三遍。细胞沉淀用1mL 1×PBS重悬并精确计数,按照相同的细胞量分装至新的1.5mL离心管中,1000×g离心5min,弃上清后完全吸弃液体,液氮速冻后,-80℃冰箱保存。 |
细胞上清 | 样品准备步骤 |
细胞上清 | 1.从培养箱中取出贴壁培养细胞,吸取大于5mL贴壁细胞的培养上清,1000g,4℃ 离心5min, 2.取全部上清,液氮速冻15min,冻存到-80℃ 冰箱内,足量干冰寄送。 |
组织样品 | 样品准备步骤 |
植物组织 | 选取干净的目标部位组织,取材均一。将样品剪切成1-2mm2小块,精确称量后装入预冷的离心管中,将盖子拧紧,在液氮速冻5min以上。或使用干净的锡箔纸包裹样品(精确称量后),再用液氮速冻5min以上,包装好的样品再放入自封袋,并清晰标示样品名称,-80℃冰箱保存。 |
动物组织 | 选取干净的目标部位组织,取材均一。用无尘吸水纸快速吸去残留的体液,将组织剪切成边长0.5cm小块或100mg左右小块,精确称量后将组织块在盛有液氮的锡纸槽中速冻,再装入液氮预冷的螺口冻存管中,迅速进行液氮速冻5min以上,转移至-80℃冰箱冻存。 |
体液样品 | 样品准备步骤 |
血清样品 | 收集全血至无抗凝剂的真空采血管,动物血清可用10-15mL离心管收集,静置30-45min,4℃,1000×g离心10min。待血细胞完全沉降到管底后,用移液器将上层血清转移到1.5mL离心管内(防止溶血),每管不低于100μL(精确量取),立即-80℃冷冻样品。 |
血浆样品 | 使用含抗凝剂的采血管,轻柔地上下颠倒混匀,持续8-10次,以混匀血液和抗凝剂,然后4℃,1000×g离心10min。待血细胞完全沉降到管底后,用移液器将上层血浆转移到1.5mL离心管内(防止溶血),每管不低于100μL(精确量取),-80℃冷冻样品。 |
注释 | 1.血清和血浆样本应为淡黄色透明液体,若发现样本变红,则表明样本采集过程中发生溶血现象,需重新制备。 2.样本制备过程中需避免污染,制备完成后要避免反复冻融,同一样本如需进行多组学检测,建议分装保存。 3.对于抗凝管的选择:代谢组学推荐使用肝素钠抗凝管(因为柠檬酸是TCA循环中的重要物质,使用柠檬酸钠抗凝剂会引入外源污染。而EDTA会影响NMR检测。但肝素钠会对RNA相关实验有负面作用,主要是因为会抑制反转录酶活性。请根据自身具体情况选用合适的抗凝管)。 4.取血时如用酒精消毒,请擦干擦拭部位,待酒精完全挥发后再取样。 |
尿液样品 | 晨起中段新鲜尿液(临床样本)或代谢笼24h新鲜尿液(动物样本)直接分装到离心管中,收集后立即4℃,1000×g离心10min,去除细胞和杂质等,收集上清液。再10000×g,于4℃下离心10min后,吸取中层澄清的尿液,用1.5mL离心管分装,(精确量取)每管1mL,-80℃冷冻样品。 |
发酵液 | 样品准备步骤 |
发酵液 | 1.收集样本后,以3000rpm,4℃的条件离心10min 2.取上清于冻存管/离心管中,液氮速冻15min,保存于-80℃ 冰箱内 3.然后将样品置于密封性好的塑料袋/样本盒中,用胶布缠到冰袋上,并在泡沫盒中装入足量的干冰进行运输 |
微生物 | 样品准备步骤 |
微生物 | 1.将培养的菌从培养箱取出,4℃ ,5000 rpm,离心5 min,弃上清 2.用预冷的PBS快速冲洗2-3次,每次清洗后4℃ ,5000 rpm,离心5 min,(保证离心后菌体的体积一致) 3.将上清完全弃去,菌体收集在 2 mL进口离心管中,液氮速冻15min,-80℃ 保存 4.然后将样品置于密封性好的塑料袋/样本盒中,用胶布缠到冰袋上,并在泡沫盒中装入足量的干冰进行运输足量干冰运输 |
微生物上清 | 样品准备步骤 |
微生物上清 | 1.将培养的菌从培养箱取出,将培养好的菌液混匀后,取大于5mL的菌液,5000rpm,4℃ 离心 10min,取全部上清,液氮速冻15min,冻存到-80℃ 冰箱内 2.然后将样品置于密封性好的塑料袋/样本盒中,用胶布缠到冰袋上,并在泡沫盒中装入足量的干冰进行运输足量干冰运输 |
粪便/肠道内容物 | 样品准备步骤 |
粪便/肠道内容物 | 1.鼠粪便:将待取样的鼠放进干净的铺有无菌滤纸的笼子里,鼠排便后立即收集粪便样本,不同的鼠取样时要更换新的滤纸;单只鼠收集3-5粒到灭菌离心管,液氮速冻,-80℃保存,干冰寄送;若单只鼠粪便样本量不足,可根据实验需求,将组内多只鼠粪便样本混合为一个样品。 2.鼠肠道内容物:在实验对象死亡后取出整个肠道,清洗肠道外表面,根据实验设计切取目标肠段;挖取内容物置于无菌离心管中,为保证实验顺利进行,尽量多采集样品,液氮速冻,-80℃保存,干冰寄送。 3.人粪便:将双手洗干净,用采样的无菌勺挖取粪便内部没有接触空气和地面的部分,挖取2满勺(2g以上)。将挖取的粪便放入采样管中,盖紧盖子,放入-80℃保存(如有条件,可进行液氮速冻)。粪便样本原则上送样不要超过10g,以防解冻时间过长造成代谢物损失。 |
唾液/泪液 | 样品准备步骤 |
唾液 | 禁食两小时以上,建议9~12am取样,4℃ 400~1000×g离心5min,取上清,再4℃,10000×g离心10min,取上清。或直接使用0.22μm滤膜过滤后离心管分装,-80℃保存。 |
泪液 | 收集样品于离心管中,4℃,10000×g离心10min,取上清到离心管内,-80℃保存。 |
土壤/污泥 | 样品准备步骤 |
土壤 | 根据实验要求取地表下不同深度的土壤,一般表层土样品需采集地表下2-3cm的样品,此层土壤有机物组成相对稳定,建议过80-100目筛(2mm)精确称量后等量分装,干冰寄送。土壤样本原则上送样不要超过10g,以防解冻时间过长造成代谢物损失。 |
污泥 | 污泥取样前需要匀质,活性污泥样本必须-80℃快速冷冻保存,不得固液混合,并且干冰寄送。 |
低浓度大体积样本 | 样品准备步骤 |
低浓度大体积样本 | 对于低浓度大体积液体样品,如发酵培养上清、活性污泥上清和海水等,代谢物浓度很低,为提取到足够的代谢物质,需要提前对大量液体进行预处理。若单个样品需要处理体积超过10mL,需对样品进行浓缩,将溶剂去除后送样,推荐采用冻干技术进行代谢物富集。 如液体中含有人为添加成份,如无机盐类,表面活性剂、洗涤剂等发泡成份,苏丹红等染色成分需及时沟通,以免影响后续实验。 |
样品包装 | 容器 | 条件 |
细胞 | 2 mL 厚壁离心管 | 干冰运输 |
动物组织 | 螺口冻存管或1.5 mL EP管 | 干冰运输 |
植物组织 | 50mL离心管 | 干冰运输 |
体液 | 1.5 mL EP管 | 干冰运输 |
注意事项: 1. 所有样品必须标记管上注明样品名称、分组信息、制备时间,且与样品登记单信息一致。 2. 将填写的样品登记单随样品一起运送。 | ||
 在线咨询
在线咨询 微信咨询
微信咨询

 电话咨询
电话咨询
联系电话:191 2100 2160
 顶部
顶部
百沐生物孵化于复旦大学,核心团队由复旦大学、中科院、协和医院等知名科研院所的卓越科学家以及来自阿里、美团、小米、生物医药集团等头部互联网科技公司和大型药企集团的综合背景精英组成,专注于将人工智能(AI)技术与生物技术(BT)深度融合,为生命科学研究和精准医疗领域带来创新解决方案。 公司核心平台为自研单细胞平台(BMBIOS)和小沐AI平台(AIGOBIO)。

微信联系我们